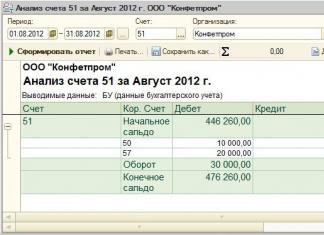
Оксиды
Соли
Кислоты
Основания
Оксиды
Классификация и номенклатура простых и сложных веществ
Лекция 3.
Тема: Классификация неорганических соединений.
Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
Химия занимается изучением превращений химических веществ (число известных к настоящему времени веществ более десяти миллионов), поэтому очень важна классификация химических соединений. Под классификацией понимают объединение разнообразных и многочисленных соединений в определенные группы или классы, обладающие сходными свойствами. С проблемой классификации тесно связана проблема номенклатуры, т.е. системы названий этих веществ. Как классификация, так и номенклатура химических соединений складывались на протяжении столетий, поэтому они не всегда являются логическими и отражают исторический путь развития науки.
Индивидуальные химические вещества принято делить на две группы: немногочисленную группу простых веществ (их, с учетом аллотропных модификаций, насчитывается около 400) и очень многочисленную группу сложных веществ.
Сложные вещества обычно делят на четыре важнейших класса: оксиды, основания (гидроксиды), кислоты, соли.
Приведенная первичная классификация уже с самого начала оказывается несовершенной. Например, в ней нет места для аммиака, соединений металлов с водородом, азотом, углеродом, фосфором и т.д., соединений неметаллов с другими неметаллами и т.д.
Перед тем, как рассмотреть более детально каждый из классов неорганических соединений, целесообразно взглянуть на схему, отражающую генетическую связь типичных классов соединений:

В верхней части схемы помещены две группы простых веществ – металлы и неметаллы, а также водород, строение атома которого отличается от строения атомов других элементов. На валентном слое атома водорода находится один электрон, как у щелочных металлов; в то же время, до заполнения электронного слоя оболочки ближайшего инертного газа – гелия - ему недостает также одного электрона, что роднит его с галогенами.
Волнистая черта отделяет простые вещества от сложных; она символизирует, что «пересечение» этой границы обязательно затрагивает валентные оболочки атомов в простых веществах, следовательно, любая реакция с участием простых веществ будет окислительно-восстановительной.
В левой части схемы под металлами помещены их типичные соединения – основные оксиды и основания, в правой части схемы помещены соединения, типичные для неметаллов, – кислотные оксиды и кислоты. Водород, помещенный в верхней части схемы, дает очень специфический, идеально амфотерный оксид – воду Н 2 О, которая в комбинации с основным оксидом дает основание, а с кислотным - кислоту. Водород в сочетании с неметаллами образует бескислородные кислоты. В нижней части схемы помещены соли, которые, с одной стороны, отвечают соединению металла с неметаллом, а с другой – комбинации основного оксида с кислотным.
Приведенная схема до некоторой степени отражает и возможности протекания химических реакций – как правило, в химическое взаимодействие вступают соединения, принадлежащие к разным половинам схемы. Так, основные оксиды реагируют с кислотными оксидами, кислотами и кислыми солями; кислоты реагируют с металлами, основными оксидами, основаниями, основными и средними солями. Естественно, что такая схема не дает исчерпывающей информации обо всех возможных реакциях, однако она отражает основные типы реакций.
Заметим, что при составлении схемы использован один старый, но очень полезный прием: формулы оснований, кислот и солей представлены на ней как комбинации оксидов. Этот прием широко применяется, например, в геологии для описания минералов. Так, формула талька Mg 3 (OH) 2 наглядно представляется другой формулой - 3MgO 4SiО 2 H 2 О; формула изумруда Be 3 Al 2 Si 6 O 18 может быть записана как ЗВеО Аl 2 О 3 6SiO 2 .
Рассмотрим подробнее отдельные классы неорганических соединений.
Классификация и номенклатура оксидов. Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород.
Оксиды делят на две группы: солеобразующие и несолеобразующие, а каждую из групп, в свою очередь, подразделяют на несколько подгрупп.

Многие элементы проявляют переменную валентность и дают оксиды различного состава, поэтому прежде всего следует рассмотреть номенклатуру оксидов.
Номенклатура химических соединений развивалась и складывалась по мере накопления фактического материала. Сначала, пока количество соединений было невелико, широко использовались тривиальные названия, специфические для каждого соединения, не отражающие состава, строения и свойства вещества, – сурик, глет, жженая магнезия, железная окалина, веселящий газ, белый мышьяк (Рb 3 O 4 , РbО, МgО, Fe 3 O 4 , N 2 O, As 2 O 3 соответственно). На смену такой номенклатуре пришла полусистематическая, стали указывать количество атомов кислорода, появились термины: закись – для более низких, окись – для более высоких степеней окисления; ангидрид – для оксидов кислотного характера.
К настоящему времени осуществлен переход на современную международную номенклатуру. Согласно этой номенклатуре любой оксид называется оксидом с указанием римскими цифрами степени окисления элемента, например: SO 2 - оксид серы (IV), SO 3 - оксид серы (VI), CrO - оксид хрома (II), Сг 2 O 3 - оксид хрома (III), СгОз - оксид хрома (VI).
Однако до сих пор в химической литературе встречаются и старые наименования оксидов (кстати, в старых названиях вместо оксида чаще использовался термин «окисел»).
Солеобразующие оксиды принято делить на три группы (основные, амфотерные, кислотные). Они подробно рассматриваются ниже.
Основные оксиды. К основным относятся оксиды типичных металлов, им соответствуют гидроксиды, обладающие свойствами оснований.
Получение основных оксидов:
1. Окисление металлов при нагревании в атмосфере кислорода:
2Mg + O 2 = 2MgO
2Cu + O 2 = 2CuO
Этот метод практически неприменим для щелочных металлов, которые при окислении обычно дают пероксиды, поэтому оксиды Nа 2 О, К 2 O крайне труднодоступны.
2. Обжиг сульфидов:
2CuS + 3O 2 = 2CuO + 2SO 2
4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов.
3. Разложение гидроксидов при нагревании:
Cu(OH) 2 = CuO + H 2 O
Этим методом нельзя получить оксиды щелочных металлов.
3. Разложение солей кислородсодержащих кислот:
BaCO 3 = BaO + CO 2
2Pb(NO 3) 2 = 2PbO + 4NO 2 + O 2
4FeSO 4 = 2Fe 2 O 3 + 4SO 2 + O 2
Этот способ получения оксидов особенно легко осуществляется для нитратов и карбонатов, в том числе и для основных солей:
2 CO 3 = 2ZnO + CO 2 + H 2 O
Свойства основных оксидов. Большинство основных оксидов представляет собой твердые кристаллические вещества ионного характера, в узлах кристаллической решетки расположены ионы металлов, достаточно прочно связанные с оксид-ионами О 2- , поэтому оксиды типичных металлов обладают высокими температурами плавления и кипения.
Отметим одну характерную для оксидов особенность. Близость ионных радиусов многих ионов металлов приводит к тому, что» в кристаллической решетке оксидов часть ионов одного металла может быть заменена на ионы другого металла. Это приводит к тому, что для оксидов часто не выполняется закон постоянства состава и могут существовать смешанные оксиды переменного состава.
Большинство основных оксидов не распадается при нагревании, исключение составляют оксиды ртути и благородных металлов:
2HgO = 2Hg + O 2
2Ag 2 O = 4Ag + O 2
Основные оксиды при нагревании могут вступать в реакции с кислотными и амфотерными оксидами, с кислотами:
BaO + SiO 2 = BaSiO 3
MgO + Al 2 O 3 = Mg(AlO 2) 2
ZnO + H 2 SO 4 = ZnSO 4 + H 2 O
Оксиды щелочных и щелочноземельных металлов непосредственно реагируют с водой:
K 2 O + H 2 O = 2KOH
CaO + H 2 O = Ca(OH) 2
Как и другие типы оксидов, основные оксиды могут вступать в окислительно-восстановительные реакции:
Fe 2 O 3 + 2Al = Al 2 O 3 + 2Fe
3CuO + 2NH 3 = 2Cu + N 2 + 3H 2 O
4FeO + O 2 = 2Fe 2 O 3
Кислотные оксиды. Кислотные оксиды представляют собой оксиды неметаллов или переходных металлов в высоких степенях окисления и могут быть получены методами, аналогичными методам получения основных оксидов, например:

Большинство кислотных оксидов непосредственно взаимодействует с водой с образованием кислот:

Заметим здесь, что наряду с современной номенклатурой для кислотных оксидов до сих пор широко используется старинная система названий их как ангидридов кислот - продуктов отщепления воды от соответствующих кислот. Как видно из вышеприведенных реакций, SО 3 - ангидрид серной кислоты, СО 2 - ангидрид угольной кислоты, Р 2 О 5 является ангидридом трех кислот (мета- фосфорной, ортофосфорной и пирофосфорной).
Наиболее типичными для кислотных оксидов являются их реакции с основными (см. выше) и амфотерными оксидами, со щелочами:

Выше упоминалось, что кислотные оксиды могут вступать в многочисленные окислительно-восстановительные реакции, например:

Амфотерные оксиды обладают двойственной природой: они одновременно способны к реакциям, в которые вступают как основные, так и кислотные оксиды, т.е. реагируют и с кислотами, и со щелочами:
![]()
К числу амфотерных оксидов относятся оксид алюминия Аl 2 О 3 , оксид хрома (III) Сr 2 О 3 , оксид бериллия ВеО, оксид цинка ZnO, оксид железа (Ш) Fe 2 O 3 и ряд других.
Идеально амфотерпым оксидом является, вода Н 2 О, которая диссоциирует с образованием одинаковых количеств ионов водорода (кислотные свойства) и гидроксид-иона (основные свойства). Амфотерные свойства воды ярко проявляются при гидролизе растворенных в ней солей:

3. Основания (гидроксиды металлов)
По современной номенклатуре их принято называть гидроксидами элементов с указанием степени окисления: КОН – гидроксид калия, NaOH – гидроксид натрия, Са(ОН) 2 – гидроксид кальция, Сг(ОН) 2 –- гидроксид хрома (II), Сг(ОН) 3 - гидроксид хрома (III).
Гидроксиды металлов принято делить на две группы: растворимые в воде (образованные щелочными и щелочноземельными металлами и поэтому называемые щелочами) и нерастворимые в воде. Основное различие между ними заключается в том, что концентрация ионов ОН - в растворах щелочей достаточно высока, для нерастворимых же оснований она определяется растворимостью вещества и обычно очень кала. Тем не менее, небольшие равновесные концентрации кона ОН - даже в растворах нерастворимых оснований определяют свойства этого класса соединений.
Получение оснований. Общим методом получения оснований является реакция обмена, с помощью которой могут быть получены как нерастворимые, так и растворимые основания:
При получении этим методом растворимых оснований в осадок выпадает нерастворимая соль.
При получении нерастворимых в воде оснований, обладающих амфотерными свойствами, следует избегать избытка щелочи, так как может произойти растворение амфотерного основания, например:
В подобных случаях для получения гидроксидов используют гид-роксид аммония, в котором амфотерные оксиды не растворяются:
Гидроксиды серебра, ртути настолько легко распадаются, что при попытке их получения обменной реакцией вместо гидроксидов выпадают оксиды;
Щелочи в технике обычно получают электролизом водных растворов хлоридов:
Щелочи могут быть также получены взаимодействием щелочных и щелочноземельных металлов или их оксидов с водой:
Химические свойства оснований. Все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов:

Наиболее характерной реакцией оснований является их взаимодействие с кислотами – реакция нейтрализации. В нее вступают как щелочи, так и нерастворимые основания:
![]()
Выше было показано, как щелочи взаимодействуют с кислотными оксидами.
Основания могут вступать в реакцию с кислыми солями:

Основания не реагируют с металлами, так как гидроксид-ион не может принять электроны от атома металла, а ионы металлов, которые могли бы быть восстановлены более активными металлами, дают нерастворимые в воде основания.
Необходимо особенно подчеркнуть способность растворов щелочей реагировать с некоторыми неметаллами (галогенами, серой, белым фосфором, кремнием):

Кроме того, концентрированные растворы щелочей при нагревании способны растворять также и некоторые металлы (те, соединения которых обладают амфотерными свойствами).
Тема урока: «Оксиды, их классификация, свойства, применение» Цель урока: познакомить обучающихся с оксидами, их составом и классификацией, рассмотреть названия оксидов, способы их получения, распространение в природе и применение. Тип урока: урок изучения и первичного закрепления знаний. Методы: беседа, устный опрос, организация упражнений по применению знаний (групповая, индивидуальная).
Ход урока:
Орг момент.
Изучение нового материала.
Сегодня мы начинаем знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые и сложные.
Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Поскольку оксиды могут быть образованы почти всеми химическими элементами (за некоторым исключением), необходимо, чтобы не было путаницы, чтобы у каждого было свое название
Называются они просто - "оксид + название элемента". Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Название оксида:
Название «Оксид» + Название элемента + (с. о. римскими
оксида в родительном падеже цифрами)
Названия оксидов зависят от числа атомов кислорода в формуле.
CO - монооксид углерода (приставка моно обозначает один) или оксид углерода (2) , угарный газ.
CO2 – диоксид углерода или оксид углерода (4) всем известный углекислый газ
Еще существуют тривиальные названия, например – углекислый газ. Угарный газ. До сих пор в химической литературе встречаются названия – закись (для более низких), окись (для более высоких с.о.) степеней окисления.
N2O– закись азота или оксид азота (1)
NO –окись азота или оксид азота (2)
Понятие «оксиды» включает бесконечное разнообразие веществ:
Таким образом среди оксидов есть твердые, газообразные и жидкие вещества.
Оксиды очень распространенный в природе класс неорганических соединений:
1) Si02 - кварцевый песок, кремнезем. Очень чистый кристаллический Si02 известен также в виде минералов горного хрусталя. Ребятам будет интересно узнать, что Si02, окрашенный различными примесями, образует драгоценные и полудрагоценные камни - яшма, аметист, агат.
Более 50% земной коры состоит из Si02.
2) А1203 2Si02 2Н20 - белая глина, учитель разъясняет, что глина, в основном состоит из оксидов алюминия и кремния. 3) руды железа - красный (Fe203), бурый (Fe203 яН20) и магнитный железняки (Fe304 или FeO Fe203).
Водная оболочка Земли (гидросфера) состоит также из оксида - оксида водорода Н20.
Оксиды входят, также в состав атмосферы - С02, СО, оксиды азота, серы и др.
Задание: Дать названия оксидам по международной номенклатуре 1
PbO, SO2, SO3, K2O, FeO, Fe2O3
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
Оксиды металлов Ме х О у
Оксиды неметаллов неМе х О у
Основные
Кислотные
Амфотерные
Кислотные
Безразличные
I, II
Ме
V-VII
Me
ZnO,BeO,Al 2 O 3 ,Fe 2 O 3
> II
неМе
I, II
неМе
CO, NO, N 2 O
Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид бериллия).
Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO 3-оксид хрома ( VI ), Mn 2 O 7 - оксид марганца (VII )).
Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III , иногда IV , а также цинк и бериллий (Например, BeO , ZnO , Al 2 O 3, Cr 2 O 3).
Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O , NO , CO ).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
CrO ( II - основный);
Cr 2 O 3 ( III - амфотерный);
CrO 3 ( VII - кислотный).
Получение оксидов
1. Горение веществ (Окисление кислородом)
а) простых веществ
2Mg +O 2 =2MgO
б) сложных веществ
2H 2 S+3O 2 =2H 2 O+2SO 2
2.Разложение сложных веществ
а) солей
СaCO 3 =CaO+CO 2
б) оснований
Cu (OH) 2 =CuO+H 2 O
в) кислородсодержащих кислот
H 2 SO 3 =H 2 O+SO 2
Физические свойства . Оксиды бывают твердые, жидкие и газообразные, различного цвета. Например, оксид меди(2) С u О черного цвета, оксид кальция СаО белого цвета - твердые вещества. Оксид серы(У1) S03 - бесцветная летучая жидкость, а оксид углерода(1У) С02 - бесцветный газ при обычных условиях.
Химические свойства . Кислотные и основные оксиды обладают разными свойствами. 2
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO 2 = CaSO 3
2. Основной оксид + Кислота = Соль + Н 2 О (р. обмена)
3 K 2 O + 2 H 3 PO 4 = 2 K 3 PO 4 + 3 H 2 O
3. (р. соединения)
Na 2 O + H 2 O = 2 NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
1. (р. соединения)
С O 2 + H 2 O = H 2 CO 3 , SiO 2 – не реагирует
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6 KOH = 2 K 3 PO 4 + 3 H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
CaO + SO 2 = CaSO 3
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 + CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 Zn ( OH ) 4 (в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов . Всем известно, какое значение имеет вода (оксид водорода) в природе, в промышленности и в быту. Многие другие оксиды также широко применяются. Например, из руд, состоящих из оксидов железа Fe203 и Fe304, получают чугун и сталь. Оксид кальция СаО (основная составная часть жженой, или негашеной, извести) используется для получения гашеной извести Са(ОН)2, которая применяется в строительстве. Нерастворимый в воде оксид кремния(4) Si02 используется в производстве строительных материалов. Некоторые из оксидов применяют для производства красок.
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
SO3 + H2O = H2SO4
CaO + H2O = Ca(OH)2
В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
Задания для закрепления 3
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl3, K2O, H2SO4, SO3, P2O5, HNO3, CaO, CO.
2. Даны вещества : CaO, NaOH, CO2, H2SO3, CaCl2, FeCl3, Zn(OH)2, N2O5, Al2O3, Ca(OH)2, CO2, N2O, FeO, SO3, Na2SO4, ZnO, CaCO3, Mn2O7, CuO, KOH, CO, Fe(OH)3
Выберите из перечня: основные оксиды, кислотные оксиды, безразличные оксиды, амфотерные оксиды и дайте им названия.
3. Закончите УХР, укажите тип реакции, назовите продукты реакции
Na2O + H2O =
N2O5 + H2O =
CaO + HNO3 =
NaOH + P2O5 =
K2O + CO2 =
Cu(OH)2 = ? + ?
4. Осуществите превращения по схеме:
1) K→K2O→KOH→K2SO4
2) S→SO2→H2SO3→Na2SO3
3) P→P2O5→H3PO4→K3PO4
Домашнее задание: параграф 30 стр., 92 упр.1-5
ОПРЕДЕЛЕНИЕ
Оксиды – класс неорганических соединений, представляют собой соединения химического элемента с кислородом, в которых кислород проявляет степень окисления «-2».
Исключение дифторид кислорода (OF 2), поскольку электроотрицательность фтора выше, чем у кислорода и фтор всегда проявляет степень окисления «-1».
Оксиды, в зависимости от проявляемых ими химических свойств подразделяют на два класса – солеобразующие и несолеобразующие оксиды. Солеобразующие оксиды имеют внутреннюю классификацию. Среди них выделяют кислотные, основные и амфотерные оксиды.
Химические свойства несолеобразующих оксидов
Несолеобразующие оксиды не проявляют ни кислотных, ни основных, ни амфотерных свойств, не образуют соли. К несолеобразующим оксидам относятся оксиды азота (I) и (II) (N 2 O, NO), оксид углерода (II) (CO), оксид кремния (II) SiO и др.
Несмотря на то, что несолеобразующие оксиды не способны к образованию солей при взаимодействии оксида углерода (II) с гидроксидом натрия образуется органическая соль – формиат натрия (соль муравьиной кислоты):
CO + NaOH = HCOONa.
При взаимодействии несолеобразующих оксидов с кислородом получают высшие оксиды элементов:
2CO + O 2 = 2CO 2 ;
2NO + O 2 = 2NO 2 .
Химические свойства солеобразующих оксидов
Среди солеобразующих оксидов различают основные, кислотные и амфотерные оксиды, первые из которых при взаимодействии с водой образуют основания (гидроксиды), вторые – кислоты, а третьи – проявляют свойства как кислотных, так и основных оксидов.
Основные оксиды реагируют с водой с образованием оснований:
CaO + 2H 2 O = Ca(OH) 2 + H 2 ;
Li 2 O + H 2 O = 2LiOH.
При взаимодействии основных оксидов с кислотными или амфотерными оксидами получаются соли:
CaO + SiO 2 = CaSiO 3 ;
CaO + Mn 2 O 7 = Ca(MnO 4) 2 ;
CaO + Al 2 O 3 = Ca(AlO 2) 2 .
Основные оксиды реагируют с кислотами с образованием солей и воды:
CaO + H 2 SO 4 = CaSO 4 + H 2 O;
CuO + H 2 SO 4 = CuSO 4 + H 2 O.
При взаимодействии основных оксидов, образованных металлами, стоящими в ряду активности после алюминия, с водородом, происходит восстановление металлов, входящих в оксида:
CuO + H 2 = Cu + H 2 O.
Кислотные оксиды реагируют с водой с образованием кислот:
P 2 O 5 + H 2 O = HPO 3 (метафосфорная кислота);
HPO 3 + H 2 O = H 3 PO 4 (ортофосфорная кислота);
SO 3 + H 2 O = H 2 SO 4 .
Некоторые кислотные оксиды, например, оксид кремния (IV) (SiO 2), не вступают в реакцию взаимодействия с водой, поэтому, соответствующие этим оксидам кислоты получают косвенным путем.
При взаимодействии кислотных оксидов с основными или амфотерными оксидами получаются соли:
P 2 O 5 + 3CaO = Ca 3 (PO 4) 2 ;
CO 2 + CaO = CaCO 3 ;
P 2 O 5 +Al 2 O 3 = 2AlPO 4 .
Кислотные оксиды реагируют с основаниями с образованием солей и воды:
P 2 O 5 + 6NaOH = 3Na 3 PO 4 + 3H 2 O;
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O.
Амфотерные оксиды взаимодействуют с кислотными и основными оксидами (см. выше), а также с кислотами и основаниями:
Al 2 O 3 + 6HCl = 2AlCl 3 + 3H 2 O;
Al 2 O 3 + NaOH + 3H 2 O = 2Na;
ZnO + 2HCl = ZnCl 2 + H 2 O;
ZnO + 2KOH + H 2 O = K 2 4
ZnO + 2KOH = K 2 ZnO 2 .
Физические свойства оксидов
Большинство оксидов – твердые вещества при комнатной температуре (CuO – порошок черного цвета, CaO – белое кристаллическое вещество, Cr 2 O 3 – порошок зеленого цвета и т.д.). Некоторые оксиды представляют собой жидкости (вода – оксид водорода – бесцветная жидкость, Cl 2 O 7 – бесцветная жидкость) или газы (CO 2 – газ без цвета, NO 2 – газ бурого цвета). Строение оксидов также различно, чаще всего молекулярное или ионное.
Получение оксидов
Практически все оксиды можно получить по реакции взаимодействия конкретного элемента с кислородом, например:
2Cu + O 2 = 2CuO.
К образованию оксидов также приводит термическое разложение солей, оснований и кислот:
CaCO 3 = CaO + CO 2 ;
2Al(OH) 3 = Al 2 O 3 + 3H 2 O;
4HNO 3 = 4NO 2 + O 2 + 2H 2 O.
Среди других способов получения оксидов выделяют обжиг бинарных соединений, например, сульфидов, окисление высших оксидов до низших, восстановление низших оксидов до высших, взаимодействие металлов с водой при высокой температуре и др.
Примеры решения задач
ПРИМЕР 1
| Задание | При электролизе 40 моль воды выделилось 620 г кислорода. Определите выход кислорода. |
| Решение |
Выход продукта реакции определяется по формуле:
η = m pr / m theor × 100%. Практическая масса кислорода – масса, указанная в условии задачи – 620 г. Теоретическая масса продукта реакции – масса, рассчитанная по уравнению реакции. Запишем уравнение реакции разложения воды под действием электрического тока: 2H 2 O = 2H 2 + O 2 . Согласно уравнению реакции n(H 2 O):n(O 2) = 2:1, следовательно n(O 2) = 1/2×n(H 2 O) = 20 моль. Тогда, теоретическая масса кислорода будет равна: |
Оксиды - это бинарные соединения элемента с кислородом, находящимся в степени окисления (-2). Оксиды являются характеристическими соединениями для химических элементов . Неслучайно Д.И. Менделеев при составлении периодической таблицы ориентировался на стехиометрию высшего оксида и объединял в одну группу элементы с одинаковой формулой высшего оксида. Высший оксид - это оксид, в котором элемент присоединил максимально возможное для него количество кислородных атомов. В высшем оксиде элемент находится в своей максимальной (высшей) степени окисления. Так, высшие оксиды элементов VI группы, как неметаллов S, Se, Te, так и металлов Cr, Mo, W, описываются одинаковой формулой ЭО 3 . Все элементы группы проявляют наибольшее сходство именно в высшей степени окисления. Так, например, все высшие оксиды элементов VI группы - кислотные.
Оксиды - это самые распространенные соединения в металлургических технологиях .
Многие металлы находятся в земной коре в виде оксидов . Из природных оксидов получают такие важные металлы, как Fe, Mn, Sn, Cr.
В таблице приведены примеры природных оксидов, используемых для получения металлов.
| Ме | Оксид | Минерал |
| Fe | Fe 2 O 3 и Fe 3 O 4 | Гематит и магнетит |
| Mn | MnO 2 | пиролюзит |
| Cr | FeO . Cr 2 O 3 | хромит |
| Ti | TiO 2 и FeO . TiO 2 | Рутил и ильменит |
| Sn | SnO 2 | Касситерит |
2ZnS + 3O 2 = 2 ZnO + 2SO 2
Природные гидроксиды и карбонаты подвергают термическому разложению, приводящему к образованию оксида.
2MeOOH = Me 2 O 3 + H 2 O
MeCO 3 = MeO + CO 2
Кроме того, поскольку металлы, находясь в окружающей среде, окисляются кислородом воздуха, а при высоких температурах, характерных для многих металлургических производств, окисление металлов усиливается, необходимы знания о свойствах получаемых оксидов.
Приведенные выше причины объясняют, почему при обсуждении химии металлов оксидам уделяется особое внимание.
Среди химических элементов металлов - 85, и многие металлы имеют не по одному оксиду, поэтому класс оксидов включает огромное количество соединений, и эта многочисленность делает обзор их свойств непростой задачей. Тем не менее, постарается выявить:
- общие свойства, присущие всем оксидам металлов,
- закономерности в изменениях их свойств,
- выявим химические свойства оксидов, наиболее широко используемых в металлургии,
- приведем некоторые из важных физических характеристик оксидов металлов.
Оксиды металлов различаются стехиометрическим соотношением атомов металла и кислорода . Эти стехиометрические соотношения определяют степень окисления металла в оксиде.
В таблице приведены стехиометрические формулы оксидов металлов в зависимости от степени окисления металла и указано, какие именно металлы способны образовывать оксиды данного стехиометрического типа.
Помимо таких оксидов, которые в общем случае могут быть описаны формулой МеО Х/2 , где Х - это степень окисления металла, существуют также оксиды, содержащие металл в разных степенях окисления, например, Fe 3 O 4 , а также, так называемые, смешанные оксиды, например, FeO . Cr 2 O 3 .
Не все оксиды металлов имеют постоянный состав, известны оксиды переменного состава, например, TiOx, где x = 0,88 - 1,20; FeOx, где x = 1,04 - 1,12 и др.
Оксиды s-металлов имеют только по одному оксиду. Металлы p- и d- блоков, как правило, имеют несколько оксидов, исключение Al, Ga, In и d-элементы 3 и 12 групп.
Оксиды типа MeO и Ме 2 О 3 образуют почти все d-металлы 4 периода . Для большинства d-металлов 5 и 6 периодов характерны оксиды, в которых металл, находится в высоких степенях окисления ³ 4 . Оксиды типа МеО, образуют только Cd, Hg и Pd; типа Me 2 O 3 , помимо Y и La, образуют Au, Rh; серебро и золото образуют оксиды типа Ме 2 O.
Стехиометрические типы оксидов металлов
| Степень окисления | Тип оксида | Металлы, образующие оксид |
| +1 | Me 2 O | Металлы 1 и 11 групп |
| +2 | MeO | Все d -металлы 4 периода (кроме Sc), все металлы 2 и 12 групп , а также Sn, Pb; Cd, Hg и Pd |
| +3 | Me 2 O 3 | Почти все d -металлы 4 периода (кроме Cu и Zn), все металлы 3 и 13 групп , Au, Rh |
| +4 | MeO 2 | Металлы 4 и 14 групп и многие другие d-металлы: V, Nb, Ta; Cr, Mo, W; Mn, Tc, Re; Ru, Os; Ir, Pt |
| +5 | Me 2 O 5 | Металлы 5 и 1 5 групп |
| +6 | MeO 3 | Металлы 6 группы |
| +7 | Me 2 O 7 | Металлы 7 группы |
| +8 | MeO 4 | Os и Ru |
Структура оксидов
Подавляющее большинство оксидов металлов при обычных условиях - это твердые кристаллические вещества. Исключение - кислотный оксид Mn 2 O 7 (это жидкость темно-зеленого цвета). Лишь очень немногие кристаллы кислотных оксидов металлов имеют молекулярную структуру, это кислотные оксиды с металлом в очень высокой степени окисления: RuO 4 , OsO4, Mn 2 O 7 , Tc 2 O 7 , Re 2 O 7 .
В самом общем виде структуру многих кристаллических оксидов металлов можно представить как регулярное трехмерное расположение кислородных атомов в пространстве, в пустотах между кислородными атомами находятся атомы металлов. Поскольку кислород - это очень электроотрицательный элемент, он перетягивает часть валентных электронов от атома металла, преобразуя его в катион, а сам кислород переходит в анионную форму и увеличивается в размерах за счет присоединения чужих электронов. Крупные кислородные анионы образуют кристаллическую решетку, а в пустотах между ними размещаются катионы металлов. Только в оксидах металлов, находящихся в небольшой степени окисления и отличающихся небольшим значение электроотрицательности, связь в оксидах можно рассматривать как ионную. Практически ионными являются оксиды щелочных и щелочноземельных металлов. В большинстве оксидов металлов химическая связь оказывается промежуточной между ионной и ковалентной . С повышением степени окисления металла вклад ковалентной составляющей возрастает.
Кристаллические структуры оксидов металлов
Координационные числа металлов в оксидах
Металл в оксидах характеризуется не только степенью окисления, но и координационным числом , указывающим, какое количество кислородных атомов он координирует .
Очень распространенным в оксидах металлов является координационное число 6, в этом случае катион металла находится в центре октаэдра, образованного шестью кислородными атомами. Октаэдры так упаковываются в кристаллическую решетку, чтобы выдерживалось стехиометрическое соотношение атомов металла и кислорода. Так в кристаллической решетке оксида кальция, координационное число кальция равно 6. Кислородные октаэдры с катионом Ca 2+ в центре так объединяются между собой, что каждый кислород оказывается в окружении шести атомов кальция, т.е. кислород принадлежит одновременно 6 атомам кальция. Говорят, что такой кристалл имеет координацию (6, 6). Первым указывается координационное число катиона, а вторым аниона. Таким образом формулу оксида СаО следовало бы записать
СаО 6/6 ≡ СаО.
В оксиде TiO 2 металл также находится в октаэдрическом окружении кислородных атомов, часть кислородных атомов соединяется противоположными ребрами, а часть вершинами. В кристалле рутила TiO 2 координация (6, 3) означает, что кислород принадлежит трем атомам титана. Атомы титана образуют в кристаллической решетке рутила прямоугольный параллепипед.
Кристаллические структуры оксидов достаточно разнообразны. Металлы могут находиться не только в октаэдрическом окружении из кислородных атомов, но и в тетраэдрическом окружении, например в оксиде BeO ≡ BeO 4|4 . В оксиде PbO, также имеющем координацию кристалла (4,4), свинец оказывается в вершине тетрагональной призмы, в основании которой находятся атомы кислорода.
Атомы металла могут находиться в разном окружении кислородных атомов, например в октаэдрических и в тетраэдрических пустотах, и металл при этом оказывается в разных степенях окисления , как например, в магнетите Fe 3 O 4 ≡ FeO . Fe 2 O 3 .
Дефекты в кристаллических решетках объясняют непостоянство состава некоторых оксидов.
Представление о пространственных структурах позволяет понять причины образования смешанных оксидов. В пустотах между кислородными атомами могут находиться атомы не одного металла, а двух разных
, как например,
в хромите FeO .
Cr 2 O 3 .
Структура рутила
Некоторые физические свойства оксидов металлов
Подавляющее большинство оксидов при обычной температуре это твердые вещества. Они имеют меньшую плотность, чем металлы.
Многие оксиды металлов являются тугоплавкими веществами . Это позволяет использовать тугоплавкие оксиды как огнеупорные материалы для металлургических печей.
Оксид CaO получают в промышленном масштабе в объеме 109 млн т/год. Его используют для футеровки печей. В качестве огнеупоров используют также оксиды BeO и MgO. Оксид MgO один из немногих огнеупоров очень устойчивых к действию расплавленных щелочей.
Иногда тугоплавкость оксидов создает проблемы при получении металлов электролизом из их расплавов. Так оксид Al 2 O 3 , имеющий температуру плавления около 2000 о С, приходится смешивать с криолитом Na 3 , чтобы снизить температуру плавления до ~ 1000 о С, и через этот расплав пропускать электрический ток.
Тугоплавкими являются оксиды d-металлов 5 и 6 периодов Y 2 O 3 (2430), La 2 O 3 (2280), ZrO 2 (2700), HfO 2 (2080), Ta 2 O 5 (1870), Nb 2 O 5 (1490), а также многие оксиды d-металлов 4 периода (см. табл.). Высокие температуры плавления имеют все оксиды s-металлов 2 группы, а также Al 2 O 3 , Ga 2 O 3 , SnО,SnO 2 , PbO (см. табл.).
Низкие температуры плавления (о С) обычно имеют кислотные оксиды: RuO 4 (25), OsO 4 (41); Te 2 O 7 (120), Re 2 O 7 (302), ReO 3 (160), CrO 3 (197). Но некоторые кислотные оксиды имеют достаточно высокие температуры плавления (о С): MoO 3 (801) WO 3 (1473), V 2 O 5 (680).
Некоторые из основных оксидов d-элементов, завершающих ряды, оказываются непрочными, плавятся при низкой температуре или при нагревании разлагаются. Разлагаются при нагревании HgO (400 o C), Au 2 O 3 (155), Au 2 O, Ag 2 O (200), PtO 2 (400).
При нагревании выше 400 о С разлагаются и все оксиды щелочных металлов с образованием металла и пероксида. Оксид Li 2 O более устойчив и разлагается при температуре выше 1000 о С.
В таблице, приведенной ниже, приводятся некоторые характеристики d-металлов 4 периода, а также s- и p-металлов.
Характеристики оксидов s- и р-металлов
| Me | Оксид | Цвет | Т пл., оС | Кислотно-основной характер |
| s-металлы | ||||
| Li | Li 2 O | белый | Все оксиды разлагаются при T > 400 о С, Li 2 O при Т > 1000 o C |
Все оксиды щелочных металлов основные, растворяются в воде |
| Na | Na 2 O | белый | ||
| K | K 2 O | желтый | ||
| Rb | Rb 2 O | желтый | ||
| Cs | Cs 2 O | оранжевый | ||
| Be | BeO | белый | 2580 | амфотерный |
| Mg | MgO | белый | 2850 | основной |
| Ca | CaO | белый | 2614 | Основные, ограниченно растворяются в воде |
| Sr | SrO | белый | 2430 | |
| Ba | BaO | белый | 1923 | |
| p-металлы | ||||
| Al | Al 2 O 3 | белый | 2050 | амфотерный |
| Ga | Ga 2 O 3 | желтый | 1795 | амфотерный |
| In | In 2 O 3 | желтый | 1910 | амфотерный |
| Tl | Tl 2 O 3 | коричневый | 716 | амфотерный |
| Tl 2 O | черный | 303 | основной | |
| Sn | SnO | темно-синий | 1040 | амфотерный |
| SnO 2 | белый | 1630 | амфотерный | |
| Pb | PbO | красный | Переходит в желтый при Т > 490 о С | амфотерный |
| PbO | желтый | 1580 | амфотерный | |
| Pb 3 O 4 | красный | Разл. | ||
| PbO 2 | черный | Разл. При 300 о С | амфотерный | |
Характеристики оксидов d-металлов 4 периода
| Оксид | Цвет | r, г/см3 | Т пл., оС | - ΔGo, кДж/моль | - ΔHo, кДж/моль | Преобладающий Кислотно-основной характер |
|
| Sc | Sc 2 O 3 | белый | 3,9 | 2450 | 1637 | 1908 | основной |
| Ti | TiO | коричневый | 4,9 | 1780, p | 490 | 526 | основной |
| Ti 2 O 3 | фиолетовый | 4,6 | 1830 | 1434 | 1518 | основной | |
| TiO 2 | белый | 4,2 | 1870 | 945 | 944 | амфотерный | |
| V | VO | серый | 5,8 | 1830 | 389 | 432 | основной |
| V 2 O 3 | черный | 4,9 | 1970 | 1161 | 1219 | основной | |
| VO 2 | синий | 4,3 | 1545 | 1429 | 713 | амфотерный | |
| V 2 O 5 | оранжевый | 3,4 | 680 | 1054 | 1552 | кислотный | |
| Cr | Cr 2 O 3 | зеленый | 5,2 | 2335 p | 536 | 1141 | амфотерный |
| CrO 3 | красный | 2,8 | 197 p | 513 | 590 | кислотный | |
| Mn | MnO | Серо-зеленый | 5,2 | 1842 | 385 | 385 | основной |
| Mn 2 O 3 | коричневый | 4,5 | 1000 p | 958 | 958 | основной | |
| Mn 3 O 4 | коричневый | 4,7 | 1560 p | 1388 | 1388 | ||
| MnO 2 | коричневый | 5,0 | 535 p | 521 | 521 | амфотерный | |
| Mn 2 O 7 | зеленый | 2,4 | 6, 55 p | 726 | кислотный | ||
| Fe | FeO | Черный | 5,7 | 1400 | 265 | 265 | основной |
| Fe 3 O 4 | черный | 5,2 | 1540 p | 1117 | 1117 | ||
| Fe 2 O 3 | коричневый | 5,3 | 1565 p | 822 | 822 | основной | |
| Co | CoO | Серо-зеленый | 5,7 | 1830 | 213 | 239 | основной |
| Co 3 O 4 | черный | 6,1 | 900 p | 754 | 887 | ||
| Ni | NiO | Серо-зеленый | 7,4 | 1955 | 239 | 240 | основной |
| Cu | Cu 2 O | оранжевый | 6,0 | 1242 | 151 | 173 | основной |
| CuO | черный | 6,4 | 800 p | 134 | 162 | основной | |
| Zn | ZnO | белый | 5,7 | 1975 | 348 | 351 | амфотерный |
Кислотно-основной характер оксидов зависит от степени окисления металла и от природы металла.
Чем ниже степень окисления, тем сильнее проявляются основные свойства. Если металл находится в степени окисления Х £ 4 , то его оксид имеет либо основной, либо амфотерный характер.
Чем выше степень окисления, тем сильнее выражены кислотные свойства . Если металл находится в степени окисления Х ≥ 5 , то его гидроксид имеет кислотный характер.
Кроме кислотных и основных оксидов существуют амфотерные оксиды, проявляющие одновременно и кислотные и основные свойства .
Амфотерны все оксиды p-металлов, кроме Tl 2 O .
Из s -металлов только Be имеет амфотерный оксид.
Среди d-металлов амфотерными являются оксиды ZnO, Cr 2 O 3 , Fe 2 O 3 , Au 2 O 3 , и практически все оксиды металлов в степени окисления +4 за исключением основных ZrO 2 и HfO 2 .
Большинство оксидов, в том числе, Cr 2 O 3 , Fe 2 O 3 и диоксиды металлов проявляют амфотерность лишь при сплавлении со щелочами. С растворами щелочей взаимодействуют ZnO, VO 2 , Au 2 O 3 .
Для оксидов, помимо кислотно-основных взаимодействий, т. е. реакций между основными оксидами и кислотами и кислотными оксидами, а также реакций кислотных и амфотерных оксидов со щелочами, характерны также окислительно-восстановительные реакции.
Окислительно-восстановительные свойства оксидов металлов
Поскольку в любых оксидах металл находится в окисленном состоянии, все оксиды без исключения способны проявлять окислительные свойства .
Самые распространенные реакции в пирометаллургии - это окислительно-восстановительные взаимодействия между оксидами металлов и различными восстановителями, приводящие к получению металла.
Примеры
2Fe 2 O 3 + 3C = 4Fe + 3CO 2
Fe 3 O 4 + 2C = 3Fe + 2CO 2
MnO 2 +2C = Mn + 2CO
SnO 2 + C = Sn + 2CO 2
ZnO + C = Zn + CO
Cr 2 O 3 + 2Al = 2Cr + Al 2 O 3
WO 3 + 3H 2 = W + 3H 2 O
Если металл имеет несколько степеней окисления, то при достаточном повышении температуры становится возможным разложение оксида с выделением кислорода.
4CuO = 2Cu 2 O + O 2
3PbO 2 = Pb 3 O 4 + O 2 ,
2Pb 3 O 4 = O 2 + 6PbO
Некоторые оксиды, особенно оксиды благородных металлов, при нагревании могут разлагаться с образованием металла.
2Ag 2 O = 4Ag + O 2
2Au 2 O 3 = 4Au + 3O 2
Сильные окислительные свойства некоторых оксидов используются на практике. Например,
Окислительные свойства оксида PbO 2 используют в свинцовых аккумуляторах, в которых за счет химической реакции между PbO 2 и металлическим свинцом получают электрический ток.
PbO 2 + Pb + 2H 2 SO 4 = 2PbSO 4 + 2H 2 O
Окислительные свойства MnO 2 также используют для получения электрического тока в гальванических элементах (электрических батарейках).
2MnO 2 + Zn + 2NH 4 Cl = + 2MnOOH
Сильные окислительные свойства некоторых оксидов приводят к их своеобразному взаимодействию с кислотами. Так оксиды PbO 2 и MnO 2 при растворении в концентрированной соляной кислоте восстанавливаются.
MnO 2 + 4HCl = MnCl 2 + Cl 2 + 2H 2 O
Если металл образует несколько оксидов, то оксиды металла в более низкой степени окисления могут окисляться, т. е. проявлять восстановительные свойства.
Особенно сильные восстановительные свойства проявляют оксиды металлов в низких и неустойчивых степенях окисления, как например. TiO, VO, CrO. При растворении их в воде они окисляются, восстанавливая воду. Их реакции с водой, подобны реакциям металла с водой.
2TiO + 2H 2 O = 2TiOOH + H 2 .
Оксиды - это бинарные соединения кислорода, то есть сложные вещества, состоящие из двух элементов, один из которых является кислород.
Э 2 +n O n -2 - общая формула оксидов, где
n - степень окисления элемента
2 - степень окисления кислорода
Названия оксидов составляется из слова "оксид" и названия элемента образующего оксид в родительном падеже (CaO - оксид кальция).
Схема классификация оксидов
Таблица классификация оксидов с примерами
|
Классификация оксидов |
Определение |
Примеры реакций |
Типичные взаимодействия |
|
Нормальные |
Оксиды, в которых есть только связи между кислородом и каким-нибудь элементом |
MgO, SO 3 , SiO 2 |
Смотрите свойства кислотных и основных оксидов |
|
Пероксиды |
Те, в которых есть связи между двумя атомами кислорода |
Na 2 O 2 , H 2 O 2 |
Смотрите таблицу свойства пероксида водорода |
|
Смешанные оксиды |
Те, которые представляют собой смесь двух оксидов одного элемента в разных степенях окисления |
Pb 3 O 4 = 2РbО · PbO 2 Fe 3 O 4 = FeO · Fe 2 O 3 |
Обладают теми же свойствами, что и входящие в их составы оксиды |
|
Кислотные или ангидриды |
Оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами - образуют соли |
SO 3 , SO 2 , Mn 2 O 7 |
SO 2 + Н 2 O → Н 2 SO 3 С основаниями и основными оксидами: Мn 2 O 7 + 2КOН → 2КМnO 4 + Н 2 O |
|
Основные оксиды |
Те, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют соли |
СаО + Н 2 O → Са(ОН) 2 С кислотами и кислотными оксидами: Na 2 O + СО 2 → Na 2 CO 3 |
|
|
Амфотерные оксиды |
Те, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов |
С кислотами: ZnO + 2НСl → ZnCl 2 + Н 2 O С щелочами: ZnO + 2NaOH + H 2 O → Na 2 |
|
|
Безразличные (несолеобразующие) |
Оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют |
NO + Н 2 O -/-> N 2 O + NaOH |
Способы получения оксидов таблица
Почти все хим. элементы образуют оксиды. На данный момент не получены оксиды гелия, неона и аргона.
|
Способы получения оксидов |
Примечание |
|
|
Взаимодействие простых веществ с кислородом |
S + O 2 → SO 2 4Аl + 3O 2 → 2Аl 2 0 3 |
Так получают преимущественно оксиды неметаллов |
|
Термическое разложение оснований, солей, кислот |
СаСО 3 t → CaO + CO 2 2H 3 BO 3 t → Bg 2 O 3 + H 2 O Mg(OH) 2 t → MgO + H 2 0 |
Так получают преимущественно оксиды металлов |
|
Взаимодействие простых веществ и солей с кислотами-окислителями |
C + 4HNO 3 (p-p) → CO 2 + 4N0 2 + H 2 O Сu + 4HNO 3 (конд.) → Cu(NO 3) 2 + 2NO 2 + 2H 2 O Na 2 SO 3 + 2H 2 SO 4 → 2NaHS0 4 + SO 2 + H 2 O |
Способ получения преимущественно оксидов неметаллов |
Химические свойства оксидов таблица
|
Классификация оксидов |
Химические свойства оксидов |
Примеры реакции |
|
Основные оксиды |
1. Основной оксид* + вода -> щелочь |
К 2 О + Н 2 О → 2КОН, ВаО + Н 2 O → Ва(ОН) 2 |
|
2. Основной оксид + кислота -> соль + вода |
CuO + H 2 SO 4 → CuSO 4 + Н 2 О |
|
|
3. Основной оксид + кислотный оксид -> соль |
MgO + СО 2 → MgCO 3 , ЗСаО + P 2 O 5 → Ca 3 (PO 4) 2 |
|
|
Кислотные оксиды |
1. Кислотный оксид + вода -> кислота |
SO 3 + Н 2 O → H 2 SO 4 Сl 2 O 7 + Н 2 О → 2НСlO 4 SiO 2 + Н 2 O -/-> нет реакции (исключение) |
|
2. Кислотный оксид + щелочь -> соль + вода |
SO 3 + 2NaOH → Na 2 SO 4 + Н 2 O |
|
|
3. Кислотный оксид + основной оксид -> соль |
SiO 2 + CaO t → CaSiO 3 , Р 2 O 4 + ЗК 2 O → 2К 3 РО 4 |
|
|
Амфотерные оксиды |
1. С кислотами реагируют как основные оксиды |
ZnO + H 2 SO 4 → ZnSO 4 + Н 2 O |
|
2. С основаниями (щелочами) реагируют как кислотные оксиды |
ZnO + 2NaOH → Na 2 ZnO 2 + Н 2 O |

_______________
Источник информации:
Насонова А.Е. Химия, школьная программа в таблицах и формулах, 1998